La calidad del sueño podría mejorar a raíz de valeriana. Los resultados de un estudio reciente sugieren que la valeriana puede ayudar a elevar la calidad del sueño , sin producir efectos secundarios [1]Bent S, Padula A, Moore D, Patterson M, Mehling W Valerian for sleep: a systematic review and meta-analysis. Am J Med 2006; 119: 1005-12.. Aquí de explicaremos como puedes utilizar valeriana y lúpulo para dormir.
Índice del contenido
- ¿Qué es el insomnio?
- Razones de usar valeriana y lúpulo para dormir
- Resultados del uso de valeriana y lúpulo para dormir
- FIGURA 3. Vista esquemática del electrohipnograma derivado de los valores SFx (índice de frecuencia espectral) que representan la profundidad del sueño en % con respecto a la vigilia máxima (ordenada). El tiempo se indica en la abscisa. La cantidad de sueño se define como el tiempo total transcurrido por debajo de un determinado SFx, en este caso el 74%.
- FIGURA 5. Gráfico de barras que muestra la diferencia entre la primera y la segunda noche, de tiempo trascurrido durante toda la noche entre valores de SFx (lndice de frecuencia espectral) desde <74% (somnolencia/ primer sueño) hasta < 50% (sueño profundo), en intervalos del 6%. Se indican los valores medios en cuantiles.
- FIGURA 6. Análisis de correlación sobre la base de la cantidad de sueño, definida por el valor SFx del 74%, y la «calidad del sueño», definida como resultado del cuestionario SF-A del Collegium lnternationale Psychiatriae Scalarum (CIPS).
- Discusión y conclusión
- Agradecimiento
¿Qué es el insomnio?
Es un trastorno del sueño frecuente que puede causar dificultad para conciliar este estado del cuerpo.
El insomnio afecta aproximadamente a un tercio de la población adulta y comporta un aumento de absentismo laboral, del gasto sanitario y de discapacidad social.
Sin embargo los estudios clínicos a doble ciego, aleatorizados y controlados con placebo son escasos y ofrecen resultados parcialmente contradictorios [2]Stevinson C, Ernst E Valerian for insomnia: a systematic review of randomized clinical trials. Sleep Med 2000;1:91-99.. En una revisión bibliográfica reciente no se encontraron evidencias suficientes de que la raíz de valeriana fuese útil para combatir el insomnio [3]Taibi DM, Landis CA, Petry H, Vitiello MV. A sistematic review of valerian as a sleep aid: safe but not effective. Sleep Med Rev 2007; 209-30..
Razones de usar valeriana y lúpulo para dormir
La afirmación de usar valeriana y lúpulo para dormir puede verse influida por diferentes razones:
- Los trastornos del sueño son muy heterogéneos. Por ello, el presente estudio se llevó a cabo en sujetos que decían dormir mal pero que no padecían ninguna enfermedad orgánica.
- Esto se comprobó mediante un examen neurológico, análisis de sangre, ECG y EEG, durante el procedimiento de pre-selección. Este grupo de personas consideradas «malos dormidores» constituyen una población más homogénea e importante.
- Los preparados vegetales contienen múltiples componentes activos, por lo que dosis más altas de extracto pueden producir efectos diferentes. Por lo tanto, la dosificación puede ser un factor esencial.
- Puede haber una gran diferencia entre los extractos líquidos de planta fresca y los extractos secos debido a la degradación o pérdida de ingredientesactivos durante la preparación de los extractos secos.
- Los diferentes métodos de análisis del sueño pueden contribuir a que se obtengan resultados contradictorios. El gran número de parámetros derivados de los registros polisomnográficos muestra un alto grado de incertidumbre con respecto a su interpretación, por ejemplo respecto a la evaluación del nivel de descanso producido por el sueño.
El objetivo del presente estudio fue evaluar la eficacia de un medicamento fitoterápico en el tratamiento agudo de la dificultad para conciliar el sueño, mediante el uso de un análisis automático, validado y de alta sensibilidad del EEG, basado en la frecuencia espectral [4]Dimpfel W Hofmann H-C, Schober F, Todorova A. Validation of an EEG-Derived Spectral Frequency lndex (SFx) for continuous monitoring of sleep depth in humans. Eur J Med Res 1998; 3: 453-460., que condujo a lo que ahora se denomina electrohipnograma.
Medicamento ensayado: Dormeasan®, Bioforce AG, Roggwil, Suiza
El Dormesan es un preparado líquido que contiene, por mililitro, 460 mg de tintura (1: 10) de raíz fresca de Valeriana otficinalis y 460 mg de tintura (1: 12 ) de estróbilo fresco de Humulus lupulus, (en etanol del 61 %).
Para su administración, por vía oral, se disolvieron 2 ml en 50 ml de agua saborizada con miel. El preparado placebo se desarrolló especialmente para este estudio y resultaba prácticamente indistinguible del verum.
Como el preparado comercial no estaba disponible en Alemania (donde se realizó el estudio), nadie podía saber cuál de los preparados, de intenso olor, era el verum.
Estudios sobre el suso de valeriana y lúpulo para dormir
Se reclutaron voluntarios sanos de ambos sexos, de entre 30 y 70 años (la edad media de los hombres era de 48,2 años y la de las mujeres de 50,2 años), que decían dormir mal y se les pidió que rellenaran un cuestionario validado sobre su sueño en las dos semanas anteriores (cuestionario sobre el sueño SF-B, de Górtelmeyer) [5]Görtelmeyer R. SF-A and SF-8- Schlaffragebogen A und B. In CIPS (Hrsg.), lnternationale Scalen für Psychiatrie (4. überarbeiete Aufi. 1996). Giittingen: Beltz Test..
Los criterios de inclusión fueron la existencia de trastornos del sueño sin complicaciones neurológicas. No se permitió el consumo de bebidas que contuviesen alcohol o cafeína durante los días y las noches del ensayo.
Quedaron excluidos los sujetos con enfermedades agudas o crónicas, apnea del sueño para somnia, EEG patológico, embarazo, enfermedades alérgicas, drogodependencia, consumo de alcohol durante los días de prueba o la toma de medicación en los 5 días previos. El peso corporal de los participantes se limitó entre 50 y 115 kg.
El estudio fue aleatorizado, a doble ciego, controlado con placebo y con grupos paralelos. Los sujetos se sometieron a un EEG dos noches consecutivas, la primera como referencia (comenzando con 10 minutos con los ojos abiertos y 10 minutos con los ojos cerrados antes de dormir) y la segunda bajo el efecto de la medicación (placebo o verum, en grupos paralelos).
Observaciones durante el estudio:
Al comienzo de la segunda noche los pacientes recibieron la medicación (verum o placebo) 15 minutos antes de que se apagaran las luces a las 22 horas.
El registro del EEG y los parámetros polisomnográficos continuó durante las siguientes 8 horas. Con este diseño cada individuo fue su propio control. Se tuvo en cuenta la diferencia entre estas dos noches consecutivas para comparar los grupos paralelos (placebo o verum).
La profundidad del sueño durante la noche varía considerablemente, con fases cíclicas, como ya se ha visto utilizando la evaluación subjetiva clásica [6]Rechtschaffen A, Kales A. A manual for standard terminology, techniques and scoring system for sleep stages of human subjects. Public Health Service 1968; US Government, Printing Office, Washington … Continuar leyendo.
Después de la validación del índice SFx de frecuencia espectral del sueño frente a estos criterios, se evidenció que estas fases muestran transiciones continuas de la vigilia al sueño profundo y otra vez al sueño ligero en un período de aproximadamente 90 minutos. La curva de tiempo resultante se denomina electrohipnograma.
EEG
Para obtener los electrohipnogramas, el EEG se registró bipolarmente desde un gorro con 17 electrodos de superficie según el sistema 10/20 internacional con Cz como electrodo de referencia física (electroencefalometría topográfica asistida por ordenador oComputer-Aided Topographical Electroencephalometry, CATEEM®).
Las señales sin procesar se amplificaron, se digitalizaron (2048 Hz/12 bits) y se transmitieron al ordenador a través de dispositivos de fibra óptica.
Utilizando el sistema de rechazo automático de artefactos del CATEEM® que elimina las alteraciones del EEG causadas por el parpadeo, la acción de tragar, la respiración, etc. durante el registro, se controló automáticamente y el investigador lo ajustó de forma individual.
Se grabaron el ECG y el Electrooculograma (EOG) en un canal cada uno para facilitar la detección de las señales superpuestas al EEG.
Se observó la configuración del mecanismo de rechazo de artefactos durante aproximadamente 3 minutos antes del inicio del registro para garantizar que todos los artefactos se eliminaran correctamente de la evaluación posterior.
Datos científicos:
Por motivos de seguridad los datos originales se guardaron, sin procesar, en un disco óptico para permitir la reevaluación del modo de rechazo de artefactos en caso necesario.
En estos casos la sesión experimental se reexaminó totalmente (fuera de registro) empleando el nuevo modo de rechazo adaptado.
La cantidad de datos rechazados se determinó automáticamente y se expresó como porcentaje del tiempo de grabación total. No obstante, un técnico cualificado supervisó y ajustó continuamente la totalidad del registro y el rechazo automático informatizado de artefactos [7]Dimpfel W, Schober F, Spüler, M. lnfiuence of Caffeine on Human EEG under Resting Conditions and while Performing Mental Arithmetic. Klin Pharmakol Akt 1992; 1: 71-72..
Las señales de la totalidad de las 17 posiciones de los electrodos se sometieron a la Transformada Rápida de Fourier, basada en barridos de segmentos secuenciales de datos de 4 segundos (ventana de Hanning).
Se analizaron los datos entre 0,86 y 35 Hz utilizando el software CATEEM®. Los espectros de frecuencia resultantes se dividen en seis bandas de frecuencias: delta (1 ,25- 4,50 Hz), theta (4,75- 6,75 Hz), alfa1 (7,00- 9,50 Hz), alfa2 (9,75 -12,50 Hz), beta1 (12,75 – 18,50 Hz) y beta2 (18, 75 – 35,00 Hz). Este análisis de frecuencias se basa en valores de potencia espectral absolutos.
El electrohipnograma se calculó fuera de registro utilizando un algoritmo patentado que utiliza la potencia theta y beta en los electrodos centrales.
Rasgos del estudio
La fórmula consistía básicamente en la suma de la potencia espectral de la banda theta + beta 1 dividida por la potencia de la banda de frecuencias beta2. El resultado de este algoritmo se ha denominado Índice de Frecuencia Espectral o Índice de Frecuencia del Sueño (Sleep Frequency index, SFx) y se ha validado según los criterios de Rechtschaffen y Kales [8]Dimpfel W Hofmann H-C, Schober F, Todorova A. Validation of an EEG-Derived Spectral Frequency lndex (SFx) for continuous monitoring of sleep depth in humans. Eur J Med Res 1998; 3: 453-460. [9]Rechtschaffen A, Kales A. A manual for standard terminology, techniques and scoring system for sleep stages of human subjects. Public Health Service 1968; US Government, Printing Office, Washington … Continuar leyendo.
La cantidad de sueño se tomó como parámetro confirmatorio previo para el análisis estadístico, después del cálculo estimativo del número de sujetos necesarios para el ensayo, en base a un estudio anterior en el que se comparaban sujetos sanos con pacientes que sufrían insomnio, ronquidos o apnea obstructiva del sueño [10]Hammer N, Todorova A, Hofmann HC, Schober F, Vonderheid-Guth B, Dimpfel W. Description of healthy and disturbed sleep by rneans of the spectral frequency index (SFx)- a retrospective analysis. Eur J … Continuar leyendo.
Estudios del sueño
El sueño se evaluó también mediante un cuestionario del sueño SF-A, del Collegium lnternationale Psychiatriae Scalarum (CIPS) [11]Görtelmeyer R. SF-A and SF-8- Schlaffragebogen A und B. In CIPS (Hrsg.), lnternationale Scalen für Psychiatrie (4. überarbeiete Aufi. 1996). Giittingen: Beltz Test.. Después de las noches de referencia y de medicación, se hizo un análisis de correlación de este parámetro derivado del EEG con el parámetro «calidad de sueño» del cuestionario.
En base al diseño en paralelo del estudio, se empleó la prueba en U de Wilcoxon, Mann y Whitney para todas las comparaciones. Se escogió esta prueba no paramétrica ya que no se puede asumir la distribución normal de los datos del EEG a pesar de que los datos se transformaron logarítmicamente.
Se utilizó, como parámetro de análisis, el tiempo consumido por debajo de una determinada profundidad de sueño según el índice de frecuencia espectral SFx.
La evaluación se basó en la comparación de las diferencias entre la primera noche (referencia) y la noche consecutiva (medicación), con respecto a los grupos paralelos placebo y verum .
Así, cada sujeto sirvió como su propio control. El protocolo del estudio se aprobó por el comité ético del Colegio de médicos del Estado federado de Hessen (Landesarztekammer Hessen, Alemania).
Resultados del uso de valeriana y lúpulo para dormir
La FIGURA 3 muestra un ejemplo representativo de los electrohipnogramas de un mismo sujeto con problemas para conciliar el sueño en la primera noche (referencia) y segunda (medicación), respectivamente.
Se observa un patrón más o menos regular de cambios periódicos. Para la evaluación cuantitativa del sueño, se determinó el tiempo total trascurrido por debajo de una profundidad del sueño del 74% según el índice SFx.
Con este método se ha observado que la transición de la vigilia al sueño comienza aproximadamente en el 80%. Por lo tanto, la profundidad del sueño del 74% identifica inequívocamente sueño. Este parámetro se utiliza para la evaluación de los cambios inducidos por los fármacos en comparación con la noche de referencia.
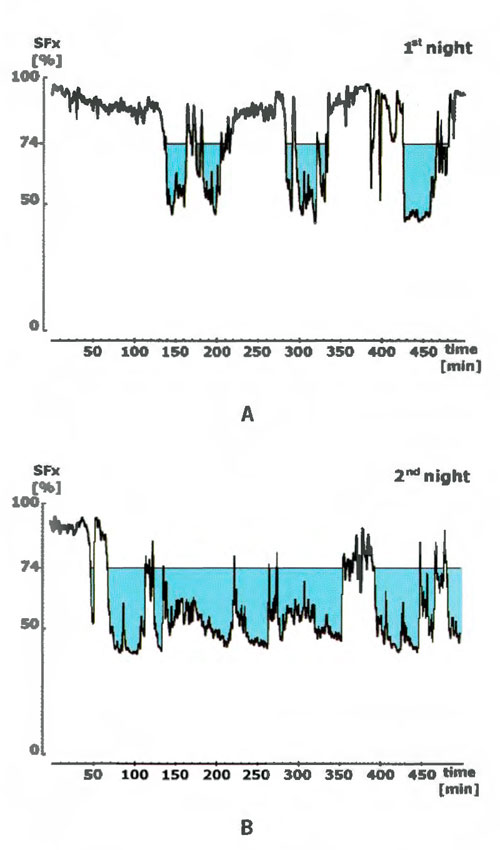
FIGURA 3. Vista esquemática del electrohipnograma derivado de los valores SFx (índice de frecuencia espectral) que representan la profundidad del sueño en % con respecto a la vigilia máxima (ordenada). El tiempo se indica en la abscisa. La cantidad de sueño se define como el tiempo total transcurrido por debajo de un determinado SFx, en este caso el 74%.
A. Ejemplo representativo de una noche de referencia.
B. Ejemplo representativo de una noche de medicación (corresponde al mismo sujeto que A).
Estos períodos individuales de sueño, de aproximadamente 90 minutos, siguen un patrón tan rígido que es posible promediar los valores de SFx (que representan la profundidad del sueño) de una noche completa en un grupo de voluntarios. Los aumentos y disminuciones periódicos de la profundidad del sueño son visibles a pesar del proceso de promediación.
Los datos de los voluntarios con trastornos del sueño del presente estudio-verum (n = 20) o placebo (n = 22) también se promediaron para obtener la media de los valores de un minuto (valores verde y rojo, para verum y placebo, respectivamente, en la FIGURA 3).
Es bastante obvio que los cambios periódicos se observan también en los sujetos que tomaron placebo, pero su sueño no alcanza la máxima profundidad. En general los sujetos tratados con la mezcla de valeriana y lúpulo duermen más profundamente durante estos periodos que los participantes del grupo placebo (FIGURA 4).
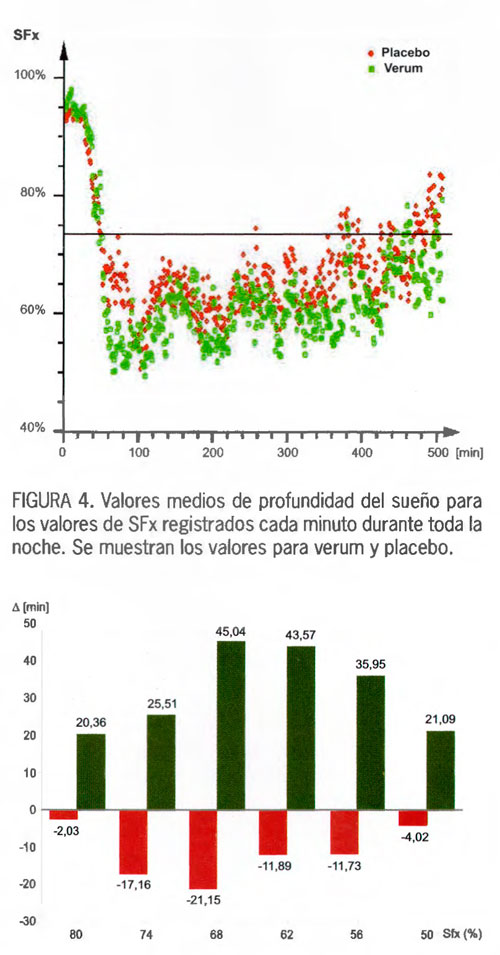
FIGURA 5. Gráfico de barras que muestra la diferencia entre la primera y la segunda noche, de tiempo trascurrido durante toda la noche entre valores de SFx (lndice de frecuencia espectral) desde <74% (somnolencia/ primer sueño) hasta < 50% (sueño profundo), en intervalos del 6%. Se indican los valores medios en cuantiles.
Las columnas verdes se refieren al verum y las columnas rojas al placebo. Todos los valores de verum < 74% fueron signifi cativamente diferentes desde el punto de vista estadistico de los valores de placebo con una probabilidad de error de p<0,01, y se contrastaron bilateralmente mediante el uso de la prueba de Wilcoxon-Mann-Whitney.
El tiempo total transcurrido por debajo de una determinada profundidad de sueno se denomina «cantidad de sueño». Se observa que los valores correspondientes al grupo de tratamiento verum son más altos en comparación con los valores del grupo placebo, siendo significativos (p<0,01) para valores de SFx = 74% e inferiores.
La FIGURA 5 representa estos valores en intervalos del 6%. La combinación de extractos de raíz de valeriana y estróbilo de lúpulo inclina el tiempo de sueño significativamente hacia el sueño más profundo (profundidad inferior al 74%).
Este efecto es más pronunciado a niveles de sueño más profundos (<68% o <62%). Por lo tanto se puede concluir que la mezcla de valeriana y lúpulo produjo un sueño significativamente más profundo.
Los resultados del cuestionario se correlacionaron con la «cantidad de sueño». Como se puede ver en la FIGURA 6, el parámetro «calidad del sueño» guardaba una correlación significativa con el parámetro «cantidad de sueño» a una profundidad del sueño del 74%.
Para la «calidad del sueño» se alcanzó un coeficiente de correlación de Pearson de 0,48 a un p<0,0001. Por lo tanto, se puede obtener una evaluación positiva de los datos cuantitativos del EEG con respecto a la mejora del sueño y también con respecto al nivel de descanso, con una única administración de la mezcla de los tinturas de raíz de valeriana y estróbilo de lúpulo.
FIGURA 6. Análisis de correlación sobre la base de la cantidad de sueño, definida por el valor SFx del 74%, y la «calidad del sueño», definida como resultado del cuestionario SF-A del Collegium lnternationale Psychiatriae Scalarum (CIPS).
La diferencia de la cantidad de sueño (AT) entre las dos noches consecutivas se indica en la abscisa, y la diferencia en el resultado «calidad del sueño» (ASFA) en la ordenada.
Discusión y conclusión
El análisis cuantitativo automático del contenido de frecuencia espectral del EEG durante la noche ha dado como resultado el desarrollo y validación de un nuevo índice de profundidad del sueño llamado índice de frecuencia espectral del sueño (SFx) [12]Dimpfel W Hofmann H-C, Schober F, Todorova A. Validation of an EEG-Derived Spectral Frequency lndex (SFx) for continuous monitoring of sleep depth in humans. Eur J Med Res 1998; 3: 453-460..
Esto condujo a la descripción cuantitativa de los cambios periódicos de la profundidad del sueño mediante el electrohipnograma, que muestra fases cíclicas. Este tipo de análisis ha demostrado ser capaz de discriminar entre sujetos sanos y pacientes que sufren insomnio, ronquidos o apnea [13]Hammer N, Todorova A, Hofmann HC, Schober F, Vonderheid-Guth B, Dimpfel W. Description of healthy and disturbed sleep by rneans of the spectral frequency index (SFx)- a retrospective analysis. Eur J … Continuar leyendo.
Mientras que la partición en 4 fases del sueño definidas artificialmente por Rechtschaffen y Kales [14]Rechtschaffen A, Kales A. A manual for standard terminology, techniques and scoring system for sleep stages of human subjects. Public Health Service 1968; US Government, Printing Office, Washington … Continuar leyendo no tuvo éxito en la descripción objetiva de la calidad del sueño, esta metodología automática asistida por ordenador consigue un parámetro más fiable para la evaluación del sueño.
Además, este análisis basado en el contenido de frecuencia espectral del EEG no utiliza las frecuencias delta, que no aumentan necesariamente, por ejemplo, durante el sueño en presencia de fármacos anestésicos.
En lugar de esto, se utiliza la potencia de las frecuencias theta y beta para definir la profundidad del sueño, ya que la potencia de las frecuencias beta2 disminuye durante el sueño sano.
Datos relevantes tras la observación
Se han observado aumentos importantes de la potencia theta espectral en ratas después de la administración de sedantes fuertes y fármacos inductores del sueño como la medetomidina [15]Dimpfel W, Schober F. Norepinephrine, EEG theta waves and Sedation in the rat. Brain Pharmacology 2001; 1: 89-97..
La actividad theta en el EEG realizado durante la vigilia ha demostrado ser un marcador de la propensión al sueño en ratas [16]Vyazovskiy W, Tobler l. Theta activity in the waking EEG is a marker of sleep propensity in the rat. Brain Res. 2005; 1050: 64-71. y humanos [17]Finelli LA, Baumann H, Borbely AA, Achermann P Dual electroencephalograrn markers of human sleep homeostasis: correlation between theta activity in waking and slow- wave activity in sleep. … Continuar leyendo.
La potencia espectral beta 1 aumenta en presencia de benzodiazepinas como diazepam o midazolam, que se recetan para la inducción del sueño en todo el mundo.
Así, este algoritmo que se define básicamente como potencia theta más beta 1 dividido por potencia beta2 (SFx) parece ser suficiente para describir la profundidad del sueño mediante el electrohipnograma, que sustituye al hipnograma de Rechtschaffen y Kales [18]Hammer N, Todorova A, Hofmann HC, Schober F, Vonderheid-Guth B, Dimpfel W. Description of healthy and disturbed sleep by rneans of the spectral frequency index (SFx)- a retrospective analysis. Eur J … Continuar leyendo.
Cantidad de sueño
El parámetro «cantidad de sueño» relacionado con una profundidad del sueño determinada que se deriva del SFx es obviamente más adecuado para describir las diferencias entre el sueño sano normal y el sueño sin descanso en los pacientes [19]Hammer N, Todorova A, Hofmann HC, Schober F, Vonderheid-Guth B, Dimpfel W. Description of healthy and disturbed sleep by rneans of the spectral frequency index (SFx)- a retrospective analysis. Eur J … Continuar leyendo.
Además, utilizando el mismo parámetro SFx como medida de profundidad del sueño, se podría mostrar que la anestesia inalterada vegetativamente (sin reacción cardiovascular del paciente durante provocaciones determinadas) tiene lugar por debajo de un valor del 68% [20]Renz D, Dimpfel W Schober F, Karliczek GF. Bedeutung, des Spektralen Frequenzindex (SFx) zur Quantifizierung der Schlaftiefe wahrend der Narkoseeinleitung. Acta Anaesthesologica Helvetica 1999; 2: … Continuar leyendo.
Apuntes
Como la interpretación de los cambios de frecuencia del EEG podría ser difícil sin un patrón de referencia, se hace necesario emplear correlaciones. En la presente investigación se observó una correlación con el parámetro «calidad del sueño» del cuestionario de sueño SF-A que se realizó a la mañana siguiente de las noches de referencia y de medicación y que se consideró como valoración subjetiva. Incluso si la correlación con r = 0,48 no es muy sólida, la probabilidad de error estadístico de p<0,0001 permite asumir la cantidad de sueño, con una profundidad de 74% SFx e inferior, como un indicador de la calidad del sueño.
La primera evidencia científica de una influencia positiva sobre el sueño alterado por el ruido utilizando una combinación de raíz de valeriana y estróbilo de lúpulo se remonta a los años setenta del siglo pasado [21]Müller-Limmroth W Ehrenstein W. Experimental studies of the effects of Seda-Kneipp on the sleep of sleep disturbed subjects; implications for the treatment of different sleep disturbances. Med Klin … Continuar leyendo.
Combinación de valeriana y lúpulo para el sueño
El éxito de la administración reiterativa de una combinación de raíz de valeriana y estróbilo de lúpulo se constató mediante el uso de varios cuestionarios (entre ellos el SF-A) [22]Schmitz M, Jackel M. Comparative study for assessing quality of lile of patients with exogenous sleep disorders (temporary sleep onset and sleep interruption disorders) treated with a hops-valerian … Continuar leyendo. Los autores de este trabajo descubrieron que el efecto era igual al de la administración de una benzodiazepina.
También hay evidencia de la eficacia de la combinación de estas drogas vegetales en administraciones reiteradas obtenida mediante estudios que utilizan exámenes polisomnográficos estándar [23]Füssel A, W A, Brattstriim. A Effect of fixed valerian-hop extract combination (ZE 91019) on sleep polygraphy in patients with non-organic insomnia: a pilot study. Eur J Med Res 2000; 5: 385-90.. La primera prueba del efecto diurno de esta combinación sobre el contenido de frecuencia del EEG se publicó el año 2000 (16).
Los resultados:
Estos resultados en las frecuencias espectrales diurnas del EEG se reprodujeron también en ratas [24]Dimpfel W, Brattstriim A, Koetter U. Central action of a fixed valerian-hops extract combination (ZE 91O19) in freely moving rats. Eur J Med Res 2006; 1: 496-500..
Un ensayo clínico multicéntrico (estudio aleatorizado, controlado por placebo, con grupos paralelos) en 184 adultos con insomnio leve reveló modestos efectos hipnóticos de la difenhidramina y de la combinación valeriana-lúpulo, determinados mediante cuestionarios [25]Morin CM, Koetter U, Ba stien C, Ware CW, Wooten V. Valerian Hops combination and diphenhydramine for treating insomnia: a randomized placebo-controlled clinical trial. Sleep 2005; 28: 1465-71..
Aunque la cantidad de fármaco que hay en 2 ml de Dormeasan® es inferior a las recomendaciones diarias de las monografías de ES-COP [26]European Scientific Cooperative on Phytotherapy. ESCOP Monographs. The Scientific foundation for herbal medicinal products. 2ª’ Edición. Exeter (Reino Unido): ESCOP, Stuttgart: Georg Thieme … Continuar leyendo para la raíz de valeriana y el estróbilo de lúpulo.
También es significativamente inferior a, por ejemplo, la formulación utilizada en el estudio de Morin [27]Morin CM, Koetter U, Ba stien C, Ware CW, Wooten V. Valerian Hops combination and diphenhydramine for treating insomnia: a randomized placebo-controlled clinical trial. Sleep 2005; 28: 1465-71., se constató un efecto agudo estadísticamente significativo de Dormeasan®en comparación con el placebo, utilizando un diseño paralelo especial en el que cada sujeto servía como su propio control.
Eficacia del Dormesan
La razón de esta eficacia podría ser la mayor concentración de aceites esenciales en el preparado Dormeasan® elaborado a partir de droga vegetal fresca, en comparación con los preparados habituales elaborados a partir de droga seca.
Para poder sustituir los medicamentos de síntesis en el tratamiento de los trastornos del sueño y evitar así la dependencia y los conocidos efectos secundarios de éstos, debe demostrarse la eficacia precisa de los medicamentos a base de plantas, mediante estudios clínicos adecuados que se realizen bajo buenas prácticas clínicas (BPC). El presente estudio siguió estas directrices y proporcionó la primera evidencia del efecto agudo de una combinación de raíz de valeriana y estróbilo de lúpulo sobre la mejora del sueño. Por lo tanto esta investigación puede ayudar a los médicos y pacientes en la elección de un producto que ayude a conciliar el sueño.
Agradecimiento
El estudio se realizó en los laboratorios clínicos de NeuroCode AG, Wetzlar (Alemania) con la financiación de Bioforce AG, Roggwil (Suiza). Los autores desean agradecer a Blerim Krasniqi y Urs Bühler, del departamento de desarrollo de productos de Bioforce y Phytolab (Vestenbergsgreuth, Alemania), la producción del placebo. La realización del ensayo fue posible gracias al compromiso de la Sra. Leoni Schombert (NeuroCode AG).
Windried Dimpfel (a)
Andy Suter (b)
a. Justus-Liebig-University Giessen, c/o NeuroCode AG, Wetzlar (Alemania).
b. Bioforce AG, Roggwil (Suiza).
Información facilitada por Laboratorios A. Vogel.
Redactor de Casa Pià
Referencias

