La clorofilina es un derivado soluble en agua de la clorofila que en diferentes modelos ha mostrado poseer (entre otras) propiedades desintoxicantes, antioxidantes, quimiopreventivas y antimutagénicas.
Índice del contenido
- Características de la Clorofilina
- Actividades de la clorofilina (CFL)
- Referencias
- McCook JP, Stephens TJ, Jiang LI, Law RM, Gotz V.Ability of sodium copper chlorophyllin complex to repair photoaged skin by stimulation of biomarkers in human extracellular matrix.Clin Cosmet Investig Dermatol. 2016 Jul 25;9:167-74.
- Jubert C, Mata J, Bench G, Dashwood R, Pereira C, Tracewell W, Turteltaub K, Williams D, Bailey G.Effects of chlorophyll and chlorophyllin on low-dose aflatoxin B(1) pharmacokinetics in human volunteers.Cancer Prev Res (Phila). 2009 Dec;2(12):1015-22.
- EFSA Journal 2015;13(6):4151 . Re-evaluation of Cu-chlorophylls (E141(i)) and Cu-chlorophyllins (E141(ii)) as food additives.
- Yin LM, Jiang HF, Wang X, Qian XD, Gao RL, Lin XJ, Chen XH, Wang LC. Effects of sodium copper chlorophyllin on mesenchymal stem cell function in aplastic anemia mice. Chin J Integr Med. 2013 May;19(5):360-6.
- Gao F, Hu XF. Analysis of the therapeutic effect of sodium copper chlorophyllin tablet in treating 60 cases of leukopenia. Chin J Integr Med. 2005 Dec;11(4):279-82.
- Berlinson MIa.Use of sodium chlorophyllin in symptomatic leukopenia in children. Pediatriia. 1974 Aug;0(8):69.
- Tachino N, Guo D, Dashwood WM, Yamane S, Larsen R, Dashwood R. Mechanisms of the in vitro antimutagenic action of chlorophyllin against benzo[a]pyrene: studies of enzyme inhibition, molecular complex formation and degradation of the ultimate carcinogen. Mutat Res. 1994;308(2):191-203.
- Dashwood R, Yamane S, Larsen R. Study of the forces of stabilizing complexes between chlorophylls and heterocyclic amine mutagens. Environ Mol Mutagen. 1996;27(3):211-218.
- Breinholt V, Schimerlik M, Dashwood R, Bailey G. Mechanisms of chlorophyllin anticarcinogenesis against aflatoxin B1: complex formation with the carcinogen. Chem Res Toxicol. 1995;8(4):506-514.
- Egner PA, Munoz A, Kensler TW. Chemoprevention with chlorophyllin in individuals exposed to dietary aflatoxin. Mutat Res. 2003;523-524:209-216.
- Kumar SS, Devasagayam TP, Bhushan B, Verma NC. Scavenging of reactive oxygen species by chlorophyllin: an ESR study. Free Radic Res. 2001;35(5):563-574.
- Park KK, Park JH, Jung YJ, Chung WY. Inhibitory effects of chlorophyllin, hemin and tetrakis(4-benzoic acid)porphyrin on oxidative DNA damage and mouse skin inflammation induced by 12-O-tetradecanoylphorbol-13-acetate as a possible anti-tumor promoting mechanism. Mutat Res. 2003;542(1-2):89-97.
- Kumar SS, Shankar B, Sainis KB. Effect of chlorophyllin against oxidative stress in splenic lymphocytes in vitro and in vivo. Biochim Biophys Acta. 2004;1672(2):100-111.
- Yun CH, Jeong HG, Jhoun JW, Guengerich FP. Non-specific inhibition of cytochrome P450 activities by chlorophyllin in human and rat liver microsomes. Carcinogenesis. 1995;16(6):1437-1440.
- Chimploy K, Díaz GD, Li Q, Carter O, Dashwood WM, Mathews CK, Williams DE, Bailey GS, Dashwood RH.E2F4 and ribonucleotide reductase mediate S-phase arrest in colon cancer cells treated with chlorophyllin.11.Int J Cancer. 2009 Nov 1;125(9):2086-94.
- Díaz GD, Li Q, Dashwood RH. Caspase-8 and apoptosis-inducing factor mediate a cytochrome c-independent pathway of apoptosis in human colon cancer cells induced by the dietary phytochemical chlorophyllin. Cancer Res. 2003;63:1254–61.
- Williams JH, Phillips TD, Jolly PE, Stiles JK, Jolly CM, Aggarwal D.13.Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions.12.Am J Clin Nutr. 2004 Nov;80(5):1106-22.
- Qian GS, Ross RK, Yu MC, et al. A follow-up study of urinary markers of aflatoxin exposure and liver cancer risk in Shanghai, People’s Republic of China. Cancer Epidemiol Biomarkers Prev. 1994;3(1):3-10.
- Egner PA, Wang JB, Zhu YR, et al. Chlorophyllin intervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer. Proc Natl Acad Sci U S A. 2001;98(25):14601-14606.
- Chernomorsky SA, Segelman AB. Biological activities of chlorophyll derivatives. N J Med. 1988;85(8):669-673.
- Siegel LH. The control of ileostomy and colostomy odors. 1960;38:634-636.
- Weingarten M, Payson B. Deodorization of colostomies with chlorophyll. Rev Gastroenterol. 1951;18(8):602-604.
- Kephart JC. Chlorophyll derivatives – their chemistry, commercial preparation and uses. Econ Bot. 1955;9:3-38.
- Bowers WF. Chlorophyll in wound healing and suppurative disease. Am J Surg. 1947;73:37-50.
- Carpenter EB. Clinical experiences with chlorophyll preparations. Am J Surg. 1949;77:167-171.
- Weir D, Farley KL. Relative delivery efficiency and convenience of spray and ointment formulations of papain/urea/chlorophyllin enzymatic wound therapies. J Wound Ostomy Continence Nurs. 2006;33(5):482-490.
- García Mª C, Altamirano M. Sales de sodio y cobre de la clorofila: usos, aplicaciones terapéuticas, actividad antimutágena y anticancerígena. TIP Revista Especializada en Ciencias Químico-Biológicas 4(2):77-86,2001.
- Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians’ Desk Reference, Inc; 2008.
- Gogel HK, Tandberg D, Strickland RG. Substances that interfere with guaiac card tests: implications for gastric aspirate testing. Am J Emerg Med. 1989;7(5):474-480.
Características de la Clorofilina
La clorofilina (CFL) es una mezcla semisintética de sales de cobre y sodio derivada de la clorofila1. La clorofila constituye el pigmento que confiere a las plantas y algas su color verde, necesario para poder llevar a cabo la fotosíntesis, siendo su estructura básica un anillo de porfirina, similar al del grupo hemo en la hemoglobina: en la clorofila, el átomo central es magnesio y en la hemoglobina hierro.
La larga cadena hidrocarbonada unida al anillo de porfirina hace que la clorofila sea soluble en grasa e insoluble en agua. En las plantas se encuentran dos tipos diferentes de clorofila (clorofila a y clorofila b), para absorber la luz en longitudes de onda ligeramente diferentes. Durante la síntesis de CFL, el átomo de magnesio en el centro del anillo se sustituye por uno de cobre y se pierde la cadena con el grupo fitol.
Propiedades
A diferencia de la clorofila natural, la CFL es soluble en agua y este hecho permite que se encuentren concentraciones apreciables en el suero sanguíneo, mientras que se carece de evidencia para la absorción significativa de clorofila después del tratamiento oral, por lo que los efectos de esta última se quedarán prácticamente restringidos al tracto digestivo, mientras que la CFL puede tener más aplicaciones debido al potencial de llegar a muchos más órganos diana. Las diferencias estructurales también hacen que la CFL sea más estable contra la oxidación y por lo tanto más fácilmente biodisponible y manejable en los diferentes complementos2.
Además de sus utilidades terapéuticas, las CFL también se usan como colorantes en alimentos, fármacos, complementos alimenticios y cosméticos. En concreto el E141ii corresponde a complejos cúpricos de clorofilinas, aditivo muy utilizado en refrescos, licores, chicles, caramelos o conservas vegetales, autorizado como aditivo alimentario en la Unión Europea en conformidad con el anexo II del Reglamento (CE) no 1333/20083.
De todas las clorofilinas, la más utilizada a nivel terapéutico y en investigación biológica es la clorofilina de sodio y cobre (CFL-Na-Cu).
Actividades de la clorofilina (CFL)
– Desintoxicación y eliminación de sustancias nocivas.
– Antioxidantes.
– Prevención del cáncer.
– Desodorantes.
– Cicatrizantes.
– Moduladoras del sistema inmune.
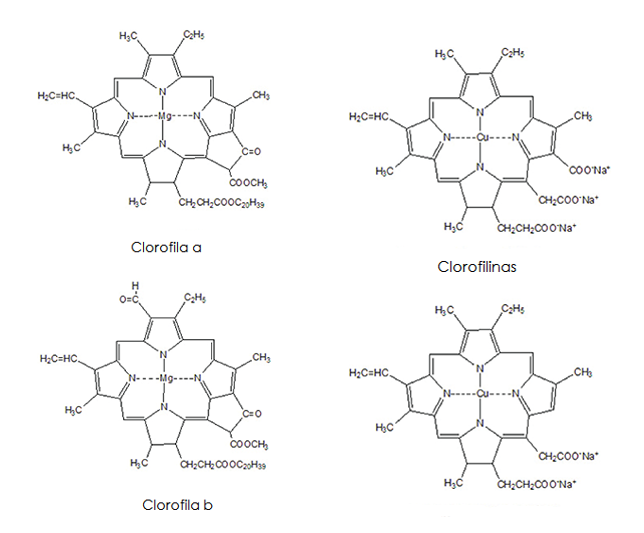
Imagen 1. Estructuras químicas de la clorofila y la clorofilina.
Teniendo en cuenta la similitud química a nivel estructural de la CLF con la hemoglobina, no es de extrañar que las primeras aplicaciones de las CLF se encaminasen hacia el tratamiento de determinados tipos de anemia, bajo el supuesto de la utilidad de sustancias pirrólicas preformadas para la construcción de la hemoglobina.
En modelos animales (ratones) se ha comprobado que la administración de CLF es de utilidad en casos de anemia aplásica (la médula ósea no produce suficientes células sanguíneas nuevas), ya que promueve la proliferación y diferenciación de las células madres mesenquimales y también mejora su capacidad inmunorreguladora4.
La CFL-Na-Cu ha mostrado efectos satisfactorios en el tratamiento de la leucopenia (cantidad anormalmente baja de glóbulos blancos) causada por diversos factores, según un estudio realizado en 105 pacientes. Los pacientes fueron asignados al azar en 3 grupos. Los 60 pacientes del primer grupo tomaron vía oral 3 comprimidos de CFL de 40 mg, tres veces por día; 30 pacientes de un segundo grupo fueron tratados con 3 comprimidos al día de 20 mg; el grupo restante incluyó a 15 pacientes, que recibieron 3 comprimidos de 100 mg de vitamina C, tres veces al día.
Todos los sujetos fueron tratados durante 1 mes. En el primer grupo, el tratamiento resultó ser eficaz en un 85%, similar al segundo (83,3%) y ambos superiores al tercero (26,7%). Los autores concluyeron que la CLF se podría utilizar en el tratamiento de la leucopenia de diversa etiología, con resultados satisfactorios en cuanto a eficacia y seguridad5. Ya en el año 1974 la CLF-Cu-Na, se usó también en el tratamiento sintomático de leucopenia en niños6.
CFL y clorofila
La clorofila y CFL son capaces de formar complejos moleculares con ciertos productos químicos conocidos o sospechosos de causar cáncer, incluyendo hidrocarburos aromáticos policíclicos encontrados en el humo del tabaco7, algunas aminas heterocíclicas presentes en la carne cocinada a altas temperaturas8 y la aflatoxina-B19. La unión de clorofila o CFL a estos potenciales carcinógenos puede interferir con su absorción gastrointestinal, reduciendo la cantidad que llega a los tejidos susceptibles de su acción10.
La CFL tiene una contrastada acción antioxidante. En estudios in vitro neutraliza físicamente variados agentes oxidantes11 y estudios en animales sugieren que los suplementos de CFL puede disminuir el daño oxidativo inducido por radiaciones y agentes químicos carcinógenos12,13.
Para iniciar el desarrollo del cáncer, algunas sustancias (procarcinógenos) primero deben ser metabolizados a carcinógenos activos que son capaces de dañar el ADN u otras moléculas críticas celulares. En modelos animales se ha evidenciado que la CFL actúa sobre varias fases del proceso de biotransformación eliminando toxinas potencialmente dañinas y carcinógenos, o inhibiendo su metabolismo14.
Un estudio en líneas celulares de cáncer de colon humano, evidenció que dichas células detienen su ciclo celular después del tratamiento con CFL. El mecanismo involucrado parece ser la inhibición de la actividad de la ribonucleótido reductasa. Esta enzima juega un papel fundamental en la síntesis y reparación del ADN y es un objetivo de determinados agentes terapéuticos contra el cáncer, utilizados en la actualidad15. También en líneas celulares de cáncer de colon humano HCT116 se ha comprobado como la CFL induce la apoptosis de estas células16.
Aflatoxina B1 (AFB1)
La aflatoxina B1 (AFB1) es un carcinógeno producido por ciertas especies de hongos y puede encontrarse en granos, legumbres o frutos deshidratados. En regiones cálidas y húmedas de África y Asia, con instalaciones de almacenamiento de grano inadecuadas, altos niveles en la dieta de AFB1 están asociados con un mayor riesgo de carcinoma hepatocelular. Por otra parte, la combinación de hepatitis junto a la exposición a AFB1, aumenta el riesgo de carcinoma hepatocelular aún más17.
Debido al largo período de tiempo entre la exposición a la AFB1 y el desarrollo de cáncer en los seres humanos, un ensayo de intervención podría requerir hasta 20 años para determinar si los suplementos de CLF podrían reducir, o no, la incidencia de carcinoma hepatocelular en las personas expuestas a altos niveles de AFB1 dietética. Sin embargo, un biomarcador de daño en el ADN inducido por AFB (la AFB1-N7 guanina), se puede medir en la orina y altos niveles urinarios de AFB1-N 7 guanina se han asociado con un riesgo significativamente mayor de desarrollar carcinoma hepatocelular18.
Datos del estudio
Con el fin de determinar si la CLF podría disminuir el daño en el ADN inducido por AFB1 en los seres humanos, se realizó un estudio de intervención, aleatorizado, doble ciego, controlado con placebo, en 180 adultos sanos que residen en una región en China (Qidong), donde el riesgo de carcinoma hepatocelular es muy alto debido a la inevitable exposición dietética a AFB1 y una alta prevalencia de infección por hepatitis B crónica.
Los participantes tomaron 100 mg de CLF o un placebo antes de las comidas tres veces al día. Después de 16 semanas de tratamiento, los niveles urinarios de AFB1-N 7 guanina eran un 55% inferiores en los que recibieron CLF, en comparación con los que tomaron placebo.
Los autores concluyeron que las intervenciones profilácticas con CLF o la complementación de la dieta con alimentos ricos en clorofila, pueden representar medios prácticos para prevenir el desarrollo de carcinoma hepatocelular u otros cánceres inducidos por el medio ambiente19.
Datos científicos
Las observaciones realizadas en los años 40-50 sobre el efecto desodorante de la CLF en su aplicación tópica sobre heridas malolientes, llevó a ensayar su uso, en este caso vía oral, en pacientes con colostomías e ileostomías con el fin de controlar el olor fecal20. La CLF, administrada en dosis de 100-200 mg/día fue eficaz en la reducción del olor fecal en pacientes de ostomía21,22.
Estudios in vitro indican que la CLF ralentiza el crecimiento de ciertas bacterias anaeróbicas y acelera la curación de heridas en animales de experimentación y en heridas abiertas persistentes en seres humanos23. La aplicación tópica de CLF promueve una curación más eficaz en úlceras vasculares y de decúbito24,25, combinándose con frecuencia a la urea y la papaína como una ayuda en el desbridamiento de heridas con el fin de reducir la inflamación local, promover la curación, y controlar el olor26.
Seguridad
El uso clínico de la CLF durante más de 50 años sin describirse efectos tóxicos, avala su buen perfil de seguridad. En tratamientos en los que se ha administrado CLF-Cu-Na en humanos, no se han observado efectos secundarios de gravedad, tóxicos, ni se han desencadenado reacciones antigénicas. Otros estudios han mostrado que no se presentan efectos citotóxicos al administrar diferentes dosis de CLF-Cu-Na27.
Cuando se toma oralmente, la CLF puede causar coloración verde de la orina o las heces, o coloración amarilla o negra de la lengua28. También se han descrito algunos casos puntuales de molestias gastrointestinales relacionadas con el uso oral de CLF. Dado que la seguridad de los suplementos con CLF no ha sido probada en mujeres embarazadas o en periodo de lactancia, el uso de CLF debe evitarse durante estas etapas. No es descartable la interacción con fármacos con acción anticoagulante o antiagregante plaquetaria. El uso de CLF vía oral puede dar lugar a resultados falsos positivos en determinadas pruebas para detectar sangre oculta en heces29.
Referencias
-
McCook JP, Stephens TJ, Jiang LI, Law RM, Gotz V.Ability of sodium copper chlorophyllin complex to repair photoaged skin by stimulation of biomarkers in human extracellular matrix.Clin Cosmet Investig Dermatol. 2016 Jul 25;9:167-74.
-
Jubert C, Mata J, Bench G, Dashwood R, Pereira C, Tracewell W, Turteltaub K, Williams D, Bailey G.Effects of chlorophyll and chlorophyllin on low-dose aflatoxin B(1) pharmacokinetics in human volunteers.Cancer Prev Res (Phila). 2009 Dec;2(12):1015-22.
-
EFSA Journal 2015;13(6):4151 . Re-evaluation of Cu-chlorophylls (E141(i)) and Cu-chlorophyllins (E141(ii)) as food additives.
-
Yin LM, Jiang HF, Wang X, Qian XD, Gao RL, Lin XJ, Chen XH, Wang LC. Effects of sodium copper chlorophyllin on mesenchymal stem cell function in aplastic anemia mice. Chin J Integr Med. 2013 May;19(5):360-6.
-
Gao F, Hu XF. Analysis of the therapeutic effect of sodium copper chlorophyllin tablet in treating 60 cases of leukopenia. Chin J Integr Med. 2005 Dec;11(4):279-82.
-
Berlinson MIa.Use of sodium chlorophyllin in symptomatic leukopenia in children. Pediatriia. 1974 Aug;0(8):69.
-
Tachino N, Guo D, Dashwood WM, Yamane S, Larsen R, Dashwood R. Mechanisms of the in vitro antimutagenic action of chlorophyllin against benzo[a]pyrene: studies of enzyme inhibition, molecular complex formation and degradation of the ultimate carcinogen. Mutat Res. 1994;308(2):191-203.
-
Dashwood R, Yamane S, Larsen R. Study of the forces of stabilizing complexes between chlorophylls and heterocyclic amine mutagens. Environ Mol Mutagen. 1996;27(3):211-218.
-
Breinholt V, Schimerlik M, Dashwood R, Bailey G. Mechanisms of chlorophyllin anticarcinogenesis against aflatoxin B1: complex formation with the carcinogen. Chem Res Toxicol. 1995;8(4):506-514.
-
Egner PA, Munoz A, Kensler TW. Chemoprevention with chlorophyllin in individuals exposed to dietary aflatoxin. Mutat Res. 2003;523-524:209-216.
-
Kumar SS, Devasagayam TP, Bhushan B, Verma NC. Scavenging of reactive oxygen species by chlorophyllin: an ESR study. Free Radic Res. 2001;35(5):563-574.
-
Park KK, Park JH, Jung YJ, Chung WY. Inhibitory effects of chlorophyllin, hemin and tetrakis(4-benzoic acid)porphyrin on oxidative DNA damage and mouse skin inflammation induced by 12-O-tetradecanoylphorbol-13-acetate as a possible anti-tumor promoting mechanism. Mutat Res. 2003;542(1-2):89-97.
-
Kumar SS, Shankar B, Sainis KB. Effect of chlorophyllin against oxidative stress in splenic lymphocytes in vitro and in vivo. Biochim Biophys Acta. 2004;1672(2):100-111.
-
Yun CH, Jeong HG, Jhoun JW, Guengerich FP. Non-specific inhibition of cytochrome P450 activities by chlorophyllin in human and rat liver microsomes. Carcinogenesis. 1995;16(6):1437-1440.
-
Chimploy K, Díaz GD, Li Q, Carter O, Dashwood WM, Mathews CK, Williams DE, Bailey GS, Dashwood RH.E2F4 and ribonucleotide reductase mediate S-phase arrest in colon cancer cells treated with chlorophyllin.11.Int J Cancer. 2009 Nov 1;125(9):2086-94.
-
Díaz GD, Li Q, Dashwood RH. Caspase-8 and apoptosis-inducing factor mediate a cytochrome c-independent pathway of apoptosis in human colon cancer cells induced by the dietary phytochemical chlorophyllin. Cancer Res. 2003;63:1254–61.
-
Williams JH, Phillips TD, Jolly PE, Stiles JK, Jolly CM, Aggarwal D.13.Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions.12.Am J Clin Nutr. 2004 Nov;80(5):1106-22.
-
Qian GS, Ross RK, Yu MC, et al. A follow-up study of urinary markers of aflatoxin exposure and liver cancer risk in Shanghai, People’s Republic of China. Cancer Epidemiol Biomarkers Prev. 1994;3(1):3-10.
-
Egner PA, Wang JB, Zhu YR, et al. Chlorophyllin intervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer. Proc Natl Acad Sci U S A. 2001;98(25):14601-14606.
-
Chernomorsky SA, Segelman AB. Biological activities of chlorophyll derivatives. N J Med. 1988;85(8):669-673.
-
Siegel LH. The control of ileostomy and colostomy odors. 1960;38:634-636.
-
Weingarten M, Payson B. Deodorization of colostomies with chlorophyll. Rev Gastroenterol. 1951;18(8):602-604.
-
Kephart JC. Chlorophyll derivatives – their chemistry, commercial preparation and uses. Econ Bot. 1955;9:3-38.
-
Bowers WF. Chlorophyll in wound healing and suppurative disease. Am J Surg. 1947;73:37-50.
-
Carpenter EB. Clinical experiences with chlorophyll preparations. Am J Surg. 1949;77:167-171.
-
Weir D, Farley KL. Relative delivery efficiency and convenience of spray and ointment formulations of papain/urea/chlorophyllin enzymatic wound therapies. J Wound Ostomy Continence Nurs. 2006;33(5):482-490.
-
García Mª C, Altamirano M. Sales de sodio y cobre de la clorofila: usos, aplicaciones terapéuticas, actividad antimutágena y anticancerígena. TIP Revista Especializada en Ciencias Químico-Biológicas 4(2):77-86,2001.
-
Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians’ Desk Reference, Inc; 2008.
-
Gogel HK, Tandberg D, Strickland RG. Substances that interfere with guaiac card tests: implications for gastric aspirate testing. Am J Emerg Med. 1989;7(5):474-480.
Licenciado en biología

